Le nouveau dossier sur le glyphosate est recevable

Le 18 août 2020, le Groupe d’évaluation du glyphosate (AGG) a conclu que le nouveau dossier scientifique soumis en juin par le Glyphosate Renewal Group (GRG) est complet et recevable, ce qui signifie qu’il satisfait aux exigences du Règlement (CE) concernant la mise sur le marché des produits phytopharmaceutiques.
Cette décision marque une étape essentielle dans la procédure de renouvellement de l’approbation du glyphosate dans l’UE, qui peut ainsi passer à la phase suivante : les autorités compétentes de France, de Hongrie, des Pays-Bas et de Suède, qui font partie de l’AGG, disposent maintenant de 11 mois pour procéder à l’examen et à l’évaluation scientifiques de notre dossier. Ce dossier contient environ 1 500 études scientifiques (dont une centaine sont nouvelles), quelque 12 000 articles scientifiques publiés sur le glyphosate ainsi que des données et des informations supplémentaires sur les bonnes relations entre glyphosate et biodiversité.
Conformément aux dispositions du Règlement (CE) concernant la mise sur le marché des produits phytopharmaceutiques, le Glyphosate Renewal Group a soumis à l’AGG un dossier contenant des preuves scientifiques de l’innocuité du glyphosate le 8 juin 2020 [1]. Le 10 juillet, l’AGG a demandé des informations pour compléter ce dossier ; le GRG a donc soumis ces informations dans le délai imparti, c’est-à-dire jusqu’au 24 juillet. La correspondance échangée avec l’AGG sur ce sujet sera bientôt disponible sur ce site web.
Suite à la réponse positive de l’AGG concernant la recevabilité du dossier sur le glyphosate, le GRG va maintenant de son plein gré publier sur son site web la partie non confidentielle du dossier soumis : ce contenu sera librement accessible à toute personne intéressée, dans les limites définies par les Règles générales de protection des données (RGPD)[2].
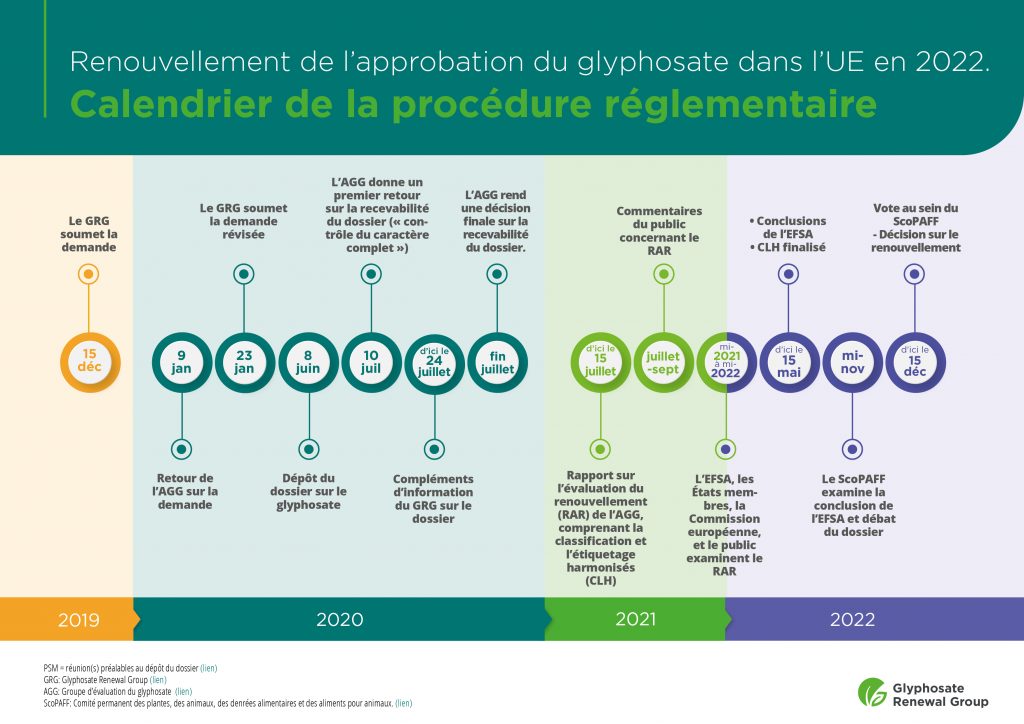
Veuillez trouver ci-dessous de plus amples informations sur le calendrier de la procédure de renouvellement de l’approbation de cette substance active dans l’UE (calendrier valable sous réserve de retard éventuel dû à des circonstances exceptionnelles).
1 Une semaine avant l’échéance du 15 juin prévue par la procédure d’approbation de l’UE pour les substances actives
2 Les informations personnelles et confidentielles ne seront pas divulguées.